ملکه زنبور عسل و عفونت های ویروسی

ملکه زنبور عسل مرکز یک کلنی برای تولید تخم و آزادسازی فرمون برای حفظ انسجام اجتماعی است. در میان بسیاری از استرسهای محیطی، ویروسها نگرانی اصلی برای به خطر انداختن سلامتی و قدرت تولید مثل ملکه هستند. ویروسها استراتژیهای متعددی را برای آلوده کردن ملکهها از طریق انتقال عمودی از والدین ملکه یا به صورت افقی از طریق کارگر و زنبورهای نر که با آنها در طول رشد، جفتگیری و در دوره تولید مثل در کلنی در تماس است، ایجاد می کنند.
تا کنون بیش از 30 ویروس مرتبط با زنبور عسل کشف شده است، اما مطالعات کمی در مورد بیماری زایی و تأثیر مستقیم ویروس ها بر فنوتیپ ملکه وجود دارد. فقدان آشکار علائم ویروس و مشکلات عملی تا حدی مقصر فقدان مطالعات است، و ما امیدواریم که تحقیقات جدید و رویکردهای روش شناختی را تحریک کنیم.
برای نشان دادن مشکلات، مطالعهای را در مورد اثرات کشنده ویروس فلج حاد اسرائیل (IAPV) توصیف میکنیم که منجر به نتایج غیرقابل قطعی شد. ما با بحث در مورد مهمترین ملاحظات روششناختی و رویکردهای جدید برای مطالعه تعاملات بین ویروسهای زنبور عسل و تعامل آنها با سلامت ملکه را به پایان میرسیم.
1. معرفی
سطوح بالای تلفات کلنی زنبور عسل نیاز به تحقیق برای شناسایی همه عوامل دخیل در بحران سلامت زنبور عسل دارد . در میان بسیاری از علل احتمالی دخیل در ضعف کلنی و مرگ "کیفیت ملکه" ضعیف اغلب توسط زنبورداران به عنوان یک عامل اصلی کمک کننده گزارش می شود . ملکه یکی از اعضای مهم کلنی زنبور عسل است و نقش اصلی او تخمریزی و آزادسازی فرمون هایی است که انسجام اجتماعی را حفظ می کند.
علاوه بر ساختار ژنتیکی ملکه، کیفیت ملکه از جمله وضعیت سلامت و قدرت تولید مثل و نتیجه مراقبت زنبورهای پرستار در طول رشد لارو ملکه، سلامت و باروری 15 زنبور نر است که او با آنها جفت گیری می کند. به طور همزمان سلامت ملکه و ظرفیت تولیدمثلی تأثیر مستقیمی بر سلامت، رفاه و قدرت کلنی ای دارد که او آنرا هدایت می کند . در بسیاری از موارد شکست یا از دست دادن ملکه منجر به مرگ و میر کلنی ها به ویژه در خارج از فصل تولید مثل می شود.
اگرچه تصور می شود ملکه توسط چندین مکانیسم ایمنی اجتماعی در کلنی محافظت می شود، اما در طول مراحل مختلف زندگی در معرض استرس های محیطی مختلف قرار می گیرد که احتمالاً اثرات منفی بر سلامت و کیفیت او دارد. در ابتدا یک ملکه می تواند تحت تأثیر محیطی قرار گیرد که والدینش در نتیجه یک پاسخ استرس تجربه کرده اند .
ملکه همچنین میتواند تحت تأثیر عوامل استرسزای محیطی مختلف در طول رشد قرار گیرد، چه از طریق قرار گرفتن در معرض عوامل استرسزای زنده یا غیرزیست در محیط کلنی یا بهویژه از طریق کیفیت یا کمیت ژل رویال که دریافت میکند. یک ملکه ممکن است پس از بلوغ ، در طول پروازهای جفتگیری و پس از شروع تخم گذاری در کلنی ، با استرس های متفاوتی مواجه شود .
تنش های محیطی می تواند پیامدهای منفی مانند کاهش قابل توجهی در بقا، و کاهش تولد را برای ملکه های در حال رشد ایجاد کند. آنها همچنین ممکن است آناتومی و فیزیولوژی تولید مثلی ملکه ها، تخمگذاری، فعالیت حرکتی و رفتار و فرکانس جفت گیری کمتر را به خطر بیندازند . در سطح مولکولی تنشهای محیطی میتوانند فعالیت بیگانه بیوتیکها، استرس اکسیداتیو و آنزیمهای سمزدایی را تغییر دهند، و همچنین بر قابلیت ایمنی ملکهها تأثیر منفی بگذارند و حساسیت به بیماری را افزایش دهند. عامل استرس زای زیستی مانند ویروس ها و نوزما می تواند از طریق جفتگیری منتقل شود ، ملکه ها را آلوده کرده و احتمالاً باعث افزایش فشار ملکه شود.
در میان عوامل استرس زای محیطی مختلف، ویروس ها به عنوان یک نگرانی عمده در مراحل مختلف زندگی یک ملکه در نظر گرفته می شوند. ویروسها انگلهای داخل سلولی اجباری هستند که دائماً استراتژیهایی را برای براندازی محیط سلولی میزبان خود و همکاری عملکرد میزبان را تکامل میدهند.
در اینجا ما ادبیات فعلی در مورد عفونتهای ویروسی ملکهها را مرور میکنیم و به دنبال آن ، یکی از مطالعات خودمان در مورد اثرات ویروس فلج حاد اسرائیل (IAPV) در ملکهها را شرح میدهیم. ما این مطالعه را مورد بحث قرار میدهیم که منجر به نتایج غیرقطعی در مورد اثرات بالقوه IAPV بر جذابیت ملکه و ایمنی بین نسلی شد تا برخی از چالشهای بالقوه را با تحقیقات تجربی بر روی اثرات فنوتیپی ویروسها بر روی ملکههای زنبور عسل برجسته کنیم.
2. حالت های انتقال ویروس به ملکه زنبور عسل
درک مسیرهای انتقال و جهت گیری انتشار ویروس اولین گام حیاتی در تعیین اثر و اپیدمیولوژی یک پاتوژن معین است، زیرا مسیرهای انتقال اثرات مستقیمی بر شیوع و حدت ویروس ها دارند. بیماری زایی اصطلاحی است که در آسیب شناسی حشرات به کار رفته است. در این متن، ما از حدت تعریف شده به عنوان "قدرت تولید بیماری یک ارگانیسم، درجه بیماری زایی در یک گروه یا گونه" استفاده می کنیم .
به طور کلی انتقال افقی منجر به تکامل اشکال بدخیم تر از پاتوژن با اثرات منفی بر بقا و تناسب اندام میزبان می شود. و در مقابل، انتقال عمودی به بقا و تولید مثل میزبان متکی است. بنابراین به طور کلی باعث کاهش حدت می شود و امکان نگهداری طولانی مدت از ویروس ها در جمعیت میزبان را فراهم می کند .رابطه بین انتقال و حدت زمانی پیچیده تر می شود که پاتوژن راه های انتقال متعددی داشته باشد که می تواند گسترش آن را تسهیل کند .
ویروسهای زنبور عسل معمولاً میتوانند از راههای متعددی منتقل شوند:
به صورت عمودی از طریق تخمک و اسپرم ذخیره شده، افقی از طریق تروفالاکسی ( خوراندن غذا بصورت دهان به دهان )، ترشحات غدد، تماس مستقیم با بدن، و ناقلها، یا از طریق جفتگیری به صورت عمودی. بر این اساس ملکههای زنبور عسل میتوانند در ابتدای رشد از اسپرمهای آلوده یا تخمدانهای آلوده به ویروسها آلوده شوند.
بررسیهای همزمان ملکهها و تخمهای آنها نشان میدهد که بسیاری از ویروسهای شناسایی شده از ملکهها مانند ویروس بال تغییر شکل (DWV)، ویروس ساکبرود (SBV)، ویروس سلول ملکه سیاه (BQCV) و ویروس زنبور کاشمر (KBV) نیز در آنها وجود داشته است . سایر ویروسها از جمله ویروس فلج مزمن زنبور عسل (CBPV)، ویروس فلج حاد زنبور عسل (ABPV)، ویروس فلج حاد اسرائیل (IAPV) و ویروس دریاچه سینا (LSV) نیز در تخمهای زنبور عسل شناسایی شدند و این موضوع نشان می دهد این ویروس ها می توانند به صورت عمودی نیز منتقل شوند.
در بیشتر موارد شیوع ویروس ها در تخم می تواند به طور گسترده ای در کلنی ها و جمعیت ها متفاوت باشد. اگرچه اکثر نمونههایی تخمی که مورد سنجش قرار گرفتهاند، فقط با یک ویروس آلوده بودند، ولی بطور معمول DWV، SBV، یا BQCV، عفونتهای ویروسی متعدد نیز در تخمهای زنبور عسل رایج است . هر تخم بارور شده آلوده به ویروس به طور بالقوه می تواند به صورت ملکه پرورش داده شود و در نتیجه عفونت ویروس را برای تمام طول عمر او حمل و به صورت عمودی منتقل کند. با این حال کمتر در مورد بیماری زایی ویروس هایی که از طریق تخم منتقل می شوند، مطالعه شده است.
چندین ویروس زنبور عسل از جمله DWV، BQCV، SBV، KBV، و ABPV در مراحل اولیه لاروی در ملکه ها شناسایی شده اند . این عفونتهای ویروسی میتوانند از والدین ملکه (به صورت عمودی) یا از زنبورهای کارگر پرستار (به صورت افقی) از طریق غذای آلوده از ترشحات غدد سرچشمه میگیرند ، منتقل میشوند. چندین ویروس از جمله IAPV، CBPV، DWV و SBV از غدد فک پایین و هیپوفارنژیال زنبورهای کارگر شناسایی شده که نشان می دهد زنبورهای پرستار می توانند عفونت ویروسی نهفته را ایجاد کنند و ویروس ها را به غذای ژل رویال و از آن طریق به ملکه ها منتقل کنند.
مصرف ذرات ویروس (SBV، BQCV، KBV، IAPV) در غذای نوزادان توسط لارو ملکه میتواند باعث عفونت شود و اگر تعداد زیادی ذرات ویروس بلعیده شود ممکن است لارو را در مراحل لارو یا شفیرگی بکشد . لازم به ذکر است که زنبورهای پرستار قادر به تجمع RNA های فعال بیولوژیکی از جمله miRNA ها، عناصر قابل انتقال و RNA غیرکدکننده در ژل رویال هستند که در ایمنی اجتماعی نقش دارند و احتمالاً در برابر عوامل بیماری زا مانند ویروس ها فعال هستند.
همچنین تجمع ویریونها (BQCV، DWV و IAPV) در موم سلولهای ملکه (و امکان انتقال ویروس بعدی) نباید در مراحل اواخر لاروی یا اوایل شفیرگی که بدن ملکه در تماس با موم است نادیده گرفته شود. برخلاف کارگران و زنبورهای نر که انتقال افقی توسط کنه انگلی Varroa که ناقل بسیاری از ویروسهای مختلف است بسیار تسهیل میشود ، لاروهای ملکه نمیتوانند ویروسهایی را از Varroa دریافت کنند زیرا کنه ها سلولهای ملکه در حال رشد را آلوده نمیکنند، مگر اینکه آلودگی کنه در سطح بسیار بالایی باشد.ملکههای در حال رشد با هر گونه علائم بیماری ، احتمالاً توسط زنبورهای کارگر نابود میشوند.
به نظر می رسد جفت گیری یک مسیر مهم انتقال ویروس ها برای آلوده کردن ملکه ها باشد. چندین ویروس مانند DWV، ABPV، BQCV و SBV از مایع منی جمعآوری شده زنبورهای به ظاهر سالم شناسایی شدهاند که شواهدی را ارائه میدهند که ملکهها میتوانند با جفتگیری یا تلقیح مصنوعی آلوده شوند . نرها میزبان های مناسببی برای کنه های Varroa هستند که می توانند تیتر ویروس و شیوع ویروس ها را در آنها افزایش دهند.
بار ویروسی زنبورهای نر به طور مستقیم بر سلامت ملکه از طریق انتقال جنسی بسیاری از ویروس ها تأثیر می گذارد. در میان ویروسهای شناساییشده در ملکهها، DWV بهطور سیستماتیک برای درک انتقال جنسی برای آلوده کردن ملکه و در نتیجه انتقال عمودی از ملکه به تخمهای تولید شده در زنبورهای عسل بررسی شده است . DWV یک علت شناخته شده مرگ و میر کلنی ها در ارتباط با ناقل آن، Varroa destructor است، و همچنین به عنوان یک مدل مطالعه مناسب عمل می کند زیرا به راحتی تمام مراحل رشد و جنسیت ها را آلوده می کند .
انتقال مقاربتی DWV از طریق تلقیح و در ملکه های جفت خورده طبیعی نشان داده شد . تیتر DWV بالا که از اندوفالی های جمع آوری شده از نرهای یافته شده از مناطق تجمع زنبورهای نر یا ملکه هایی که از پروازهای جفت گیری خود بازمی گردند شناسایی شده است، نشان می دهد که انتقال جنسی DWV می تواند در طول جفت گیری طبیعی رخ دهد. در نتیجه انتقال مقاربتی، ملکه های جوان جفت خورده با ویروس های بیشتری نسبت به ملکه های جوان باکره آلوده می شوند .
ملکههای جفت خورده مسنتر ، مستعد آلوده شدن با تعداد بیشتری از ویروسها، از جمله DWV، SBV، BQCV، و کمپلکس AKI (ABPV، KBV، و IAPV) در تیترهای عفونت بالاتر هستند. در بسیاری از موارد، همان ویروسهایی که در بافتهای ملکه شناسایی میشوند را میتوان در میان کارگران همان کلنی نیز شناسایی کرد، که نشان میدهد کارگران میتوانند ملکه را از طریق تروفالاکسی یا تماس بدنی آلوده کنند . انتقال ویروس از طریق تماس بدنی نزدیک بین کارگران آلوده و ملکه ها به طور مستقیم برای IAPV نشان داده شد. فرمون های ملکه ، زنبورهای کارگر را جذب می کنند تا ملکه را احاطه کنند و با آنتن دهی، نظافت و تغذیه با او تعامل کنند.
از آنجایی که کارگران ملازم معمولاً جوان هستند (و بنابراین تماس کمی با محیط خارجی کندو دارند)، ممکن است یک مانع فیزیکی و اجتماعی برای محافظت از ملکه در برابر بیماری و کاهش قرار گرفتن ملکه در معرض عوامل عفونی ایجاد کنند. با این وجود باز هم ملکهها در معرض آلودگی قرار میگیرند و ملکههای مسنتر در طول عمر طولانیتر خود در کلنی تعامل بیشتری با زنبورهای کارگر داشتهاند و ویروسها را به شیوهای وابسته به سن جمعآوری میکنند. اینکه آیا پیری ایمنی به افزایش تیترهای ویروسی ملکههای مسنتر کمک میکند، باز میتواند جای سوال داشته باشد.
3. اثرات مستقیم ویروس ها بر سلامتی ملکه ها
تاکنون بیش از 30 عامل بیماریزای ویروسی برای آلوده کردن زنبورهای عسل گزارش شده ،که برخی از آنها اخیراً شناسایی و مشخص شده اند . در غیاب عوامل استرس زای زیستی (مثلاً کنه واروآ ) و غیرزیست (مثلاً قرار گرفتن در معرض آفت کش ها، تغذیه نامناسب)، بیشتر عفونت های ویروسی بدون ایجاد علائم یا علائم بالینی در سطح فرد یا کلنی پنهان می مانند . اما با این حال یک عفونت ویروسی آشکار می تواند باعث تغییرات رفتاری، فیزیولوژیکی و تشریحی، از جمله تغییر شکل، فلج، یا مرگ شود .
با توسعه تکنیکهای مولکولی، تشخیص و تعیین کمیت ویروسها از کل ملکهها یا قسمتهای خاص بدن انها کار آسان میشود، اما ارتباط بین تیترهای ویروس و علائم پاتولوژیک در ملکههای زنبور عسل و به طور کلی به خوبی درک نشده است. به عنوان مثال CBPV باعث دو شکل مختلف سندرم، مستقل از Varroa ، اما احتمالاً مرتبط با سایر عوامل استرس زا می شود . به طور خاص، اثرات پاتولوژیک ویروس ها در ملکه ها به خوبی تعریف نشده است، زیرا مشاهده علائم پاتولوژیک از یک فرد منفرد که در مرکز کلنی زندگی می کند دشوار است و احتمالاً در صورت به خطر افتادن سلامتی، به سرعت توسط همنوعان او با یک ملکه جدید جایگزین می شود. بنابراین اثرات مستقیم سلامتی ملکهها ، معمولاً در آزمایشگاه یا در ملکههای مسنتر با عفونتهای پیشرفته فقط برای چند ویروس مورد مطالعه قرار گرفته است .
در نتیجه اطلاعات کمی در مورد چگونگی تأثیر عفونت های ویروسی بر رفتار، فیزیولوژی، تولید مثل و طول عمر ملکه ها وجود دارد. ویروسهای متعددی (DWV، SBV، CBPV، ABPV، KBV، و IAPV) از ملکههایی با ظاهر گرم شناسایی شدهاند که نشان میدهد عفونت میتواند توسط ویروس منفرد یا چندگانه در یک ملکه رخ دهد .
ویروس ها قسمت های مختلف بدن ملکه از جمله سر، قفسه سینه، تخمدان ها، اسپرماتکا و چربی بدن را آلوده می کنند . اگرچه ویروسها را میتوان از تمام قسمتها و بافتهای بدن شناسایی کرد، اما برخی از ویروسها درجه قابلتوجهی از ویژگی بافتی دارند. به عنوان مثال به نظر می رسد DWV در بافت های تولید مثل، تخمدان ها و اسپرماتکا متمرکز شده است، اما به طور مستقیم در سلول های چربی بدن نیز مشاهده می شود. IAPV همچنین انواع بافت ها و مراحل تاریخچه زندگی را آلوده می کند، اما با غلظت بالایی در روده، تخمدان ها و اسپرماتک ملکه های آلوده یافت می شود .
مطالعات مختلف نشان میدهد که ویروسهای بسیار بدخیم، مانند ویروسهای موجود در کمپلکس AKI، به ندرت در ملکههای جوان باکره شناسایی میشوند، اما گاهی اوقات در ملکههای مسنتر هم با تیتر پایین یافت میشوند. این الگو ممکن است به این دلیل ایجاد شود که این ویروس های بدخیم زنبورهای کارگر پرستار را می کشند و بنابراین به ندرت به ملکه های در حال رشد منتقل می شوند. علاوه بر این آنها به سرعت هر ملکه جوان آلوده را می کشند.
ملکههای مسنتر ممکن است از طریق تماس فیزیکی آلوده شوند که میتواند منجر به عفونت بدخیمی کمتری شود . از طرف دیگر این ویروسها ممکن است بیشتر در ملکههای مسنتر کشف شوند، زیرا تیترهای ویروسی عفونتهای پنهان که در ابتدا کمتر از حد تشخیص هستند، ممکن است با افزایش سن افزایش یابد و در مقابل ویروسهای کمخطر (مثلاً DWV، SBV، و BQCV) را میتوان به آسانی از ملکههای باکره و جوان شناسایی کرد و شیوع و تیتر آنها معمولاً با افزایش سن به سطوح قابلتوجهی افزایش مییابد بدون اینکه ملکهها را بکشند یا منجر به حذف شوند.
تا کنون چندین ویروس از جمله DWV، SBV، و ABPV از لارو یا شفیره ملکه ها شناسایی شده اند ، اما قابل توجه ترین علائم پاتولوژیک عفونت ویروس در طول توسعه توسط BQCV ایجاد می شود که به عنوان شایع ترین علت مرگ لارو ملکه شناخته شده است. عفونت BQCV رشد را در مراحل مختلف متوقف می کند و منجر به ظاهر زرد کم رنگ و وجود پوستی کیسه مانند می شود. پس از مرگ، لارو به تدریج سیاه می شود و ظاهری تیره و "روغنی" به سلول ملکه می دهد. در مقابل، ملکه های بالغ از علائم آشکار حتی اگر دارای عیار بالایی از BQCV باشند هم رنج نمی برند.
علائم بالینی خاص در ملکه ها برای CBPV و DWV مورد مطالعه قرار گرفته است. حتی اگر کلنیها به دلیل عفونت CBPV با ملکههای ظاهراً سالم از بین بروند، آلودگی به CBPV ، تغذیه و عفونتهای موضعی ملکهها میتواند باعث لرزش پاها، بالهای گسترش یافته و از هم گسسته و گاهی شکمهای پر از همولنف و کیسههای عسل متورم شده شود . به نظر می رسد علائم پاتولوژیک DWV در ملکه ها به کلنی هایی با جمعیت بسیار فراوان Varroa که باعث افزایش تیتر ویروسی DWV می شود ، محدود باشد. در این موارد ملکه ها می توانند بال های فلج و تخمدان های منحط، البته بدون همبستگی دقیق بین تیتر DWV و تخریب تخمدان را نشان دهند. همچنین مشخص شد که عفونت DWV با تعداد اسپرم های ذخیره شده همبستگی منفی داشته و ممکن است باعث غلبه بر ملکه شود.
4. مطالعه موردی اثرات IAPV بر جذابیت ملکه و پوشش ایمنی
در تلاشی برای گسترش دانش خود در مورد اثرات کشنده عفونتهای ویروسی در ملکههای زنبور عسل، مطالعهای برای آزمایش این فرضیه انجام شد که عفونت ویروسی جذابیت ملکه را کاهش میدهد و فرزندان ملکههای در معرض ویروس بهتر از تلقیح با همان ویروس به دلیل وجود بینالمللی زنده میمانند. اثرات پوشش ایمنی نسلی حتی اگر نتایج این مطالعه هم بینتیجه بماند، ما آن را برای برجسته کردن رویکردهای بالقوه و نوآوری روششناختی مورد نیاز برای پیشرفت کلی در درک اثرات ویروسها بر میزبان زنبور عسل توصیف میکنیم.
فرضیه کاهش جذابیت ملکه بر اساس یافته هایی است که عفونت ویروسی می تواند پروفایل هیدروکربنی کوتیکولی را تغییر دهد و منجر به شناسایی و حذف افراد بیمار شود . تعاملات ملکه و کارگر توسط ملکه تعدیل می شود تا از خود در برابر کارگران آلوده به IAPV محافظت کند . با این حال مشخص نیست که آیا ویروس ها می توانند رفتار کارگران را نسبت به ملکه های آلوده تغییر دهند یا خیر.
فرضیه دوم مزایای بقای بین نسلی از قرار گرفتن در معرض ویروس قبلی با یافتههایی در زنبورهای عسل در برابر بیماریهای باکتریایی است. IAPV می تواند تغییرات قابل توجهی در متیلاسیون DNA و الگوهای رونویسی در زنبورهای کارگر آلوده ایجاد کند که به طور بالقوه بر سطوح پروتئین و پاسخ عملکردی به عفونت تأثیر می گذارد . این احتمال وجود دارد که مکانیسمهای دفاعی القایی در برابر ویروسها در زنبورهای عسل وجود داشته باشد که میتواند برای آغازگر ایمنی فرزندان در برابر IAPV استفاده شود. پرایم ایمنی در برابر ویروس ها از سایر حشرات گزارش شده اما تا کنون هیچ داده ای در زنبورهای عسل وجود ندارد.
بنابراین ملکه های آزمایشی توسط پروتکل های استاندارد پرورش ملکه از کلنی های به ظاهر سالم تولید شدند و پس از جفت گیری و شروع تولیدمثل، ملکه های آزمایشی یا با IAPV تلقیح شدند یا تحت درمان شم قرار گرفتند. چندین روز پس از درمان، جذابیت ملکه های در معرض IAPV و شاهد با ثبت انتخاب رفتاری کارگران در یک دستگاه بویایی سنج دو طرفه مقایسه شد .پس از آزمایش های ترجیحی، ملکه های در معرض IAPV و کنترل مجدداً به کلنی های خود معرفی شدند تا فرزندان کارگری تولید کنند که برای بقای یک تلقیح موضعی IAPV در شرایط آزمایشگاهی مقایسه شد. در پایان مطالعه، تیترهای IAPV تمام ملکههای باقیمانده توسط PCR کمی در زمان واقعی اندازهگیری شد .
ترجیحات کارگری برای ملکه های در معرض یا کنترل ویروس فلج حاد اسرائیل (IAPV). برای هر جفت ملکه، ده کارگر مستقل در یک بویایی سنج دو طرفه قرار داده شدند تا بین بوهای یک ملکه کنترل (سمت چپ) تلقیح شده با IAPV (سمت چپ) و شم درمان شده (راست) به مدت ده دقیقه یکی را انتخاب کنند. اگرچه کارگران ملکه تلقیح شده با IAPV را به طور قابل توجهی بیشتر از ملکه کنترل در یک جفت (نوار پایین) انتخاب کردند، اما هیچ اولویت کلی با توجه به درمان تجربی در همه جفتها مشاهده نشد.
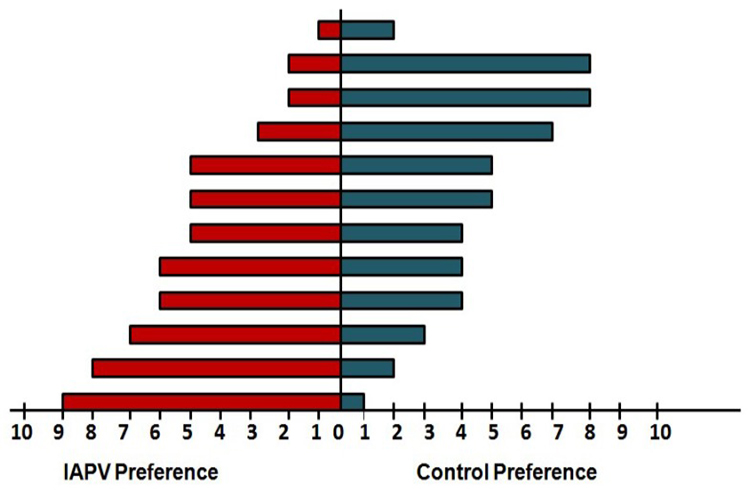
شکل 1 : ترجیحات کارگری برای ملکه های در معرض یا کنترل ویروس فلج حاد اسرائیل (IAPV). برای هر جفت ملکه، ده کارگر مستقل در یک بویایی سنج دو طرفه قرار داده شدند تا بین بوهای یک ملکه کنترل (سمت چپ) تلقیح شده با IAPV (سمت چپ) و شم درمان شده (راست) به مدت ده دقیقه یکی را انتخاب کنند. اگرچه کارگران ملکه تلقیح شده با IAPV را به طور قابل توجهی بیشتر از ملکه کنترل در یک جفت (نوار پایین) انتخاب کردند، هیچ اولویت کلی با توجه به درمان تجربی در همه جفتها مشاهده نشد.
به طور کلی، فرزندان ملکه های تحت درمان با IAPV و تحت درمان با IAPV تفاوت معنی داری در زنده ماندن از تلقیح IAPV نداشتند (آزمون کروسکال-والیس: Χ 2 = 0.7, Nprimed = 134, Nunprimed = 128, p = 0.404; Figure 2). Individual queens were significantly different from each other (Log-rank test: Χ2 = 25.2، df = 15، p = 0.047)، و بقای فرزندان برای ملکه های تحت درمان با شم نسبت به ملکه های در معرض IAPV متغیرتر بود.
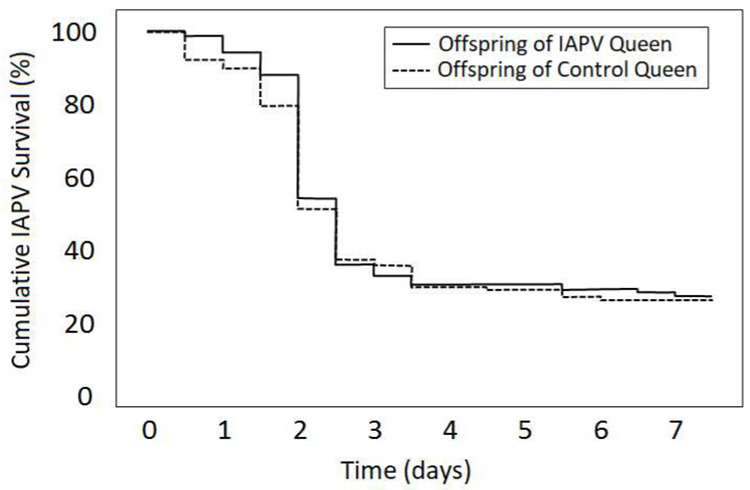
شکل 2 : بقای فرزندان تلقیح شده با IAPV از ملکه های در معرض IAPV و شاهد. بقای IAPV کارگران تولید شده توسط هشت ملکه که از قبل در معرض IAPV قرار گرفته بودند با کارگران هشت ملکه شاهد تحت درمان شم در قفس های آزمایشگاهی مقایسه شد. با وجود تنوع قابل توجهی در بین ملکه ها (داده ها نشان داده نشده است)، بقای فرزندان از ملکه های تلقیح شده تفاوت معنی داری با بقای فرزندان ملکه های غیر آلوده نداشت.
در پایان مطالعه، ملکههای زندهمانده با سطوح پایین IAPV، بدون در نظر گرفتن گروه درمانی، یافت شدند. تنها دو ملکه از گروه تحت درمان با IAPV در پایان آزمایش به شدت با IAPV آلوده شدند ( شکل 3 ).
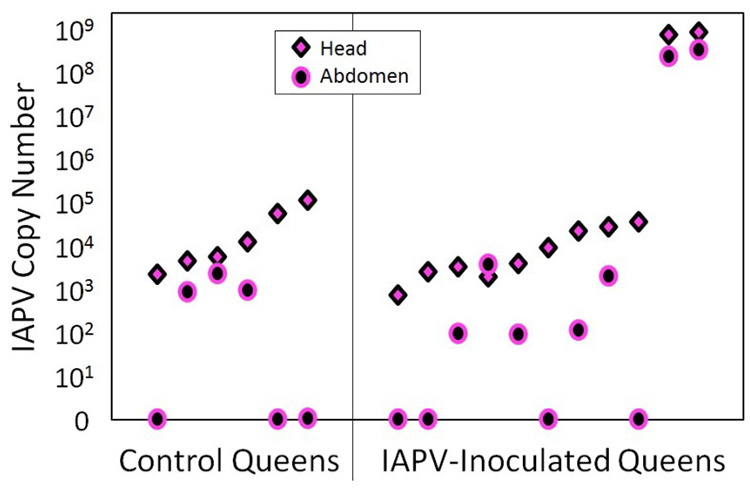
شکل 3 : عفونت IAPV ملکه های آزمایشی پس از پایان آزمایش. IAPV توسط RT-qPCR در تمام ملکههای گروه شاهد تلقیح شده با IAPV و گروه کنترل شم، بدون تفاوت معنیداری در مقادیر IAPV بین گروههای تیمار شناسایی شد، اگرچه دو
5. بحث
ملکه ها به عنوان یک نگرانی اصلی برای سلامت زنبور عسل نقش ایفا می کنند و در نتیجه توجه بیشتری را در رابطه با بیماری های ویروسی به خود جلب کرده اند. با کمک توالی یابی نسل بعدی، بسیاری از ویروس های جدید در زنبورهای عسل ثبت شده اند ، اما دانش ما از توزیع، مسیرهای عفونت و بیماری زایی در ملکه ها محدود است.
علائم آلودگی ها در ملکه ها با کارگران متفاوت است:
اغلب ویروس ها شاید برای تسهیل درانتقال خود علائم واضحی را در ملکه ها ایجاد نمی کنند. با این حال برخی از عفونت های آشکار مستند شده است که عملکرد ملکه را مختل می کند، همانطور که در بالا بحث شد ، بسیاری از مطالعات فعلی بر روی شناسایی و انتقال ویروس ها متمرکز شده اند و به زودی پیشرفت قابل توجهی در درک اپیدمیولوژی ویروسی در زنبورهای عسل انتظار می رود. مطالعات بیشتری به ویژه برای روشن کردن اثرات ویروسی ظریف و حل این سوال که چه چیزی باعث ایجاد علائم آشکار ویروس های زنبور عسل می شود، مورد نیاز است. اثرات و علائم کشنده احتمالاً در زنبورهای عسل مربوط به کاست خاص است و علیرغم دشواری های ملکه به مطالعات خاصی روی ملکه ها نیاز دارد.
به امید ایجاد انگیزه در توسعه روش شناختی و کمک به دیگران برای برنامه ریزی آزمایش های مورد نیاز، مطالعه موردی خود را شرح دادیم زیرا بسیاری از این مشکلات را نشان می دهد. دو مشکل مهم در مورد مطالعه فوق این است که ملکه های کنترل شده ما در پایان آزمایش حاوی IAPV بودند و اینکه تنها دو ملکه ما که با IAPV تلقیح شده بودند تیترهای بالای IAPV مورد انتظار را نشان دادند. حتی اگر همه ملکه ها از یک کلنی به ظاهر سالم پیوند زده شده باشند ، توضیحات متعددی برای هر دو پیامد وجود دارد.
IAPV ممکن است بخوبی تشخیص داده نشده باشد و افزایش تیتر ممکن است توسط استرس تجربی یا سایر عوامل محیطی ایجاد شده باشد. از طرف دیگر ملکه ها ممکن است در طول دوره قبل از آزمایش در کندوهای خود آلوده شده باشند، که ممکن است در طول جفت گیری طبیعی آنها یا در نتیجه اشتراک آنها در زنبورستان آزمایشی با ملکه های تلقیح شده با IAPV رخ داده باشد.
زنبورستانهای جدا شده برای ملکههای آلوده و شاهد ممکن است خطر عفونت را برای ملکههای کنترل کاهش دهد، اما میتوانست تفاوتهای بالقوه مخدوشکننده دیگری را بین گروههای آزمایشی ایجاد کند. فقدان تیترهای بالای IAPV مورد انتظار در ملکه های تلقیح شده ممکن است نشان دهد که روش تلقیح ما در این نمونه خاص ، حتی اگر آزمایش های اولیه برای اطمینان از مؤثر بودن روش ما انجام شده بود ، ناکارآمد بوده است.
از طرف دیگر اکثر ملکه های زنده مانده ممکن است با موفقیت عفونت IAPV را تا پایان آزمایش به سطوح پایین پاک کنند. دوز و پویایی زمانی پاسخ ایمنی نگرانی آشکاری برای مطالعات ویروس کشنده است. یک روش کلیدی برای فعال کردن این نوع مطالعات و جمعآوری دادههای قطعیتر در آینده، تکنیکی برای نظارت بر تیتر ویروس در افراد زنده در طول یک آزمایش است. نمونه برداری از مدفوع و تخمک پیشنهاد شده است .
اما در مورد مدفوع، القای اجابت مزاج در فواصل منظم دشوار است و ما رویکردی را در نظر می گیریم که بیشتر شبیه پایش ویروس در مهره داران است، هرچند در مقیاس بسیار کوچکتر. نمونه های خیلی کوچک همولنف باید برای RT-qPCR کافی باشد، که حتی روی سلول های منفرد نیز انجام می شود . علاوه بر این چنین تکنیکی برای غربالگری از قبل همه افراد در یک مطالعه بسیار مفید خواهد بود، نه تنها از نظر ویروس تحت بررسی، بلکه همچنین برای سایر بیماریهایی که در غیر این صورت ممکن است اثرات درمان را مبهم کنند.
مطالعاتی که روی ملکههای زنبور عسل در شرایط عادی تمرکز میکنند، لزوماً در حجم نمونه محدود هستند، زیرا یک ملکه نیاز به نگهداری کلنی دارد . در مطالعه ما، این موضوع منجر به استفاده مکرر از چندین ملکه کنترل شد. این شکل از تکرار شبه از تجزیه و تحلیل آماری کلی جلوگیری کرد، مشکلی که می توان با برنامه ریزی دقیق منابع مورد نیاز و جمع آوری حدود 50 درصد ملکه های اضافی برای جایگزینی ملکه هایی که قبل از تکمیل آزمایش می میرند، از آن جلوگیری کرد.
حجم کم نمونه در تست های ترجیحی زوج های ملکه منفرد نیز قدرت آماری آنها را محدود می کند، اما مطالعات رفتاری بدون اتوماسیون سنجش ها بسیار وقت گیر هستند. به همین ترتیب آزمون پرایمینگ ایمنی با حجم نمونه کم مواجه شد. مطالعات دینامیک مرگ و میر به اندازه های نمونه بسیار بالاتر و تکرارهایی که در بسیاری از تکرارها توزیع شده اند به دلیل تصادفی بودن ذاتی مرگ و میر، به ویژه در مطالعات قفس آزمایشگاهی نیاز دارند . در نهایت برنامه نمونه برداری برای جمعآوری فرزندان نیز ممکن است ما را از یافتن یک اثر باز داشته باشد، زیرا پرایمینگ ایمنی میتواند گذرا باشد. و فرزندان باید در چند نقطه زمانی پس از تلقیح ملکه با IAPV آزمایش شده باشند.
نتیجه مطالعه !
فعل و انفعالات بین ویروس ها و میزبان ملکه زنبور عسل آنها برای حفظ سلامت گرده افشان اهمیت عملی دارد زیرا ملکه ها نقش مهمی در انتقال عمودی بسیاری از ویروس های مرتبط با سلامت دارند. تحقیقات بیشتری برای مستندسازی توزیع ویروس ها و پویایی آنها در فضا و زمان مورد نیاز است.
کشف مداوم ویروسها یا سویههای ویروس جدید را میتوان پیشبینی کرد که مستلزم تلاشهای نظارت مستمر است. این امر به ویژه در مورد عملیات پرورش ملکه زنبور عسل که زنبورهای خود را به طور گسترده بین مشتریان خود توزیع می کنند صادق است. جایگزینی برای نظارت بر ویروس در پرورش دهندگان ملکه، تلاش های محلی و کوچک برای پرورش ملکه می تواند خطر انتشار ویروس به کمک انسان در فواصل طولانی را کاهش دهد.
فراتر از اهمیت عملی تحقیقات بیشتر درباره ویروس در ملکههای زنبور عسل، زنبورهای عسل فرصتهای منحصر به فردی را برای مطالعه روابط بین فیزیولوژی میزبان، انتقال و تکثیر ویروس، و بیماریزایی ویروس ارائه میکنند. به طور خاص، تأثیر متقابل بین جنسیت، تکامل بیماری زای بالقوه متفاوت، و مکانیسمهای ایمنی اجتماعی باید مورد توجه عمومی باشد.
با این حال ما معتقدیم که بسیاری از مشکلات تجربی که تحقیقات در مورد فعل و انفعالات بین ویروسها و ملکههای زنبور عسل را پیچیده میکنند، باید قبل از اینکه مطالعات قطعی بتوانند درک فعلی ما از روابط ملکه و ویروس و همچنین ویروسشناسی زنبور عسل را به طور کلی بهبود بخشند، مورد بررسی قرار گیرند.
پی نوشت واژه ها
ویروس تغییر شکل بال (DWV) - ویروس ساکبرود یا لارو کیسه ای (SBV) - ویروس سلول سیاه ملکه (BQCV) - ویروس زنبور کاشمر (KBV) - ویروس فلج مزمن زنبور عسل (CBPV) - ویروس فلج حاد زنبور عسل (ABPV) - ویروس فلج حاد اسرائیل (IAPV) - ویروس دریاچه سینا (LSV)
نویسندگان : Esmaeil Amiri, Micheline K. Strand, David R. Tarpy, Olav Rueppell









